C. 致死させることはないが発病あるいは不顕性感染を起こす微生物
Bordetella bronchiseptica (気管支敗血症菌)
気管支敗血症菌は、グラム陰性の短桿菌で、ラット、モルモット、ウサギ、フェレット、イヌ、ネコ、ブタおよびサル類などの呼吸器から分離される。伝播力は強く、異種動物間でも相互に伝染する。なかでもモルモットとブタは特に感受性が高く、モルモットでは気管支性肺炎とそれにともなう衰弱がみられ、幼若動物では死亡することがある。モルモットにおける典型的な症状は、立毛、水様~膿性鼻汁の排出と鼻孔周囲の汚れ、発咳、体重減少、削痩などである。病変は化膿性気管支炎あるいは気管支性肺炎である。またラットからも分離されることがあるが、病原性は十分に明らかにされていない。
本菌は主として咳、くしゃみを介した経鼻感染により伝播する。伝播力は強く、感染動物からの菌の排出は感染後2~3日後から始まり、同居動物は4~5日後にほぼ全例が感染する。また本菌は乾燥に強いため、飼育器材、実験器具に付着し、しばらく生存するため、これらを介しての感染伝播にも注意を要する。
検査法には菌分離、凝集反応による抗体検査があるが、確定診断のためには菌分離が最適である。菌分離方法は、鼻腔および気管粘膜のフキトリ材料を血液寒天培地およびDHL寒天培地に塗抹後、37℃、48時間培養する。
Bordetella hinzii/ pseudohinzii
マウスに呼吸器疾患を引き起こすグラム陰性桿菌である。
免疫能が正常なマウスにおいて多くは不顕性感染で推移するが、時に呼吸器症状 (異常呼吸音など) を引き起こし、肉眼病変 (肺の肝変化等) を形成することがある。不顕性感染で推移している個体でも、病理組織学的検査において鼻腔粘膜に炎症像が観察される例が多い。免疫不全マウスからのB. hinzii の分離例は2010年現在までないが、scidマウスの実験感染において、致死性の呼吸器感染症を引き起こすことが確認されている。
診断法は、呼吸器 (鼻腔・気管腔など) から菌分離を行い、生化学的性状検査、PCR法などにより同定を行う。
Cilia-associated respiratory (CAR) bacillus (カーバチルス)
カーバチルスは、気管や気管支粘膜上皮細胞の線毛部に存在するグラム陰性の細長い桿菌であり、2016年にFilobacterium rodentium と命名された。
マウス、ラット、ウサギが感受性動物であるが、実験動物で問題となるのはラットである。本菌は直接接触感染によってラット間に伝播し、空気感染、間接接触感染および胎盤感染は主たる伝播経路にならない。通常、不顕性感染であるが、発病した場合には慢性経過をたどり、異常呼吸音を発し、呼吸困難などを呈する場合がある。マイコプラズマなどの他の呼吸器病原体との混合感染によって、化膿性気管支肺炎を引き起こす。
本菌は人工培地での発育が困難なため、診断法は抗体検査、PCR法検査、病理組織学的検査である。
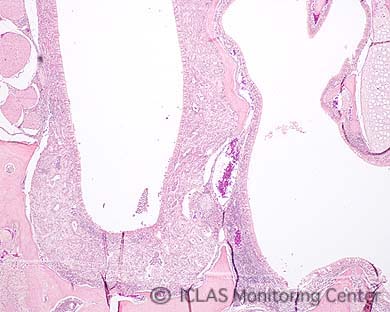
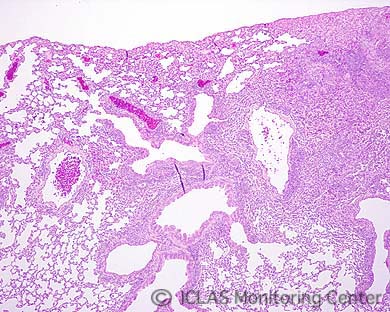
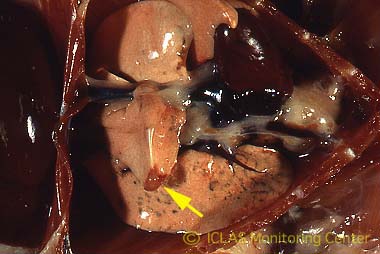
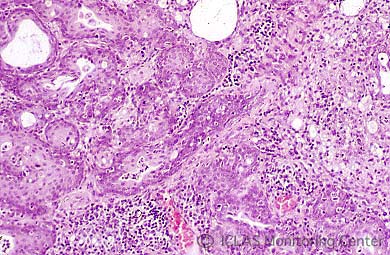
左: CAR bacillus自然感染ラットの肺病変: 肺赤色変化 (矢印)
右: CAR bacillus自然感染ラットの肺組織 (Warthin-Starry染色) : 気管支上皮細胞の線毛に好銀性細菌の付着 (矢印)
Citrobacter rodentium (腸粘膜肥厚症菌)
マウスの腸粘膜肥厚症の起因菌は、従来Escherichia coli O115a,c:K(B)であるとされていたが、現在では生物学的性状、遺伝子解析および病原性からみて、Citrobacter rodentium に統一されている。本菌は、MacConkey寒天培地やDHL寒天培地で中心部がピンクで周辺が透明な光沢のあるコロニーを形成するグラム陰性桿菌であり、乳糖分解は遅い。
感受性動物はマウスであり、生後2~3週齢の発症率はもっとも高く、水溶性下痢を呈し、発症個体の多くは2~5日後で死亡する。成熟マウスではほとんどが無症状で推移する。本菌は感染動物との接触感染、糞便の経口感染により伝播する。
診断法は、病変部あるいは糞便を、DHL寒天培地やMacConkey寒天培地などの腸内細菌分離用培地にて37℃、18~20時間培養し、菌分離を行う。
Clostridium piliforme (Tyzzer's organism: ティザー菌)
ティザー菌は、偏性細胞内寄生性で、芽胞を形成し、周毛性鞭毛を有する針状のグラム陰性長大桿菌である。感染肝などのスタンプ標本をギムザ染色すると、菌体上に数個のアズール顆粒が確認される。人工培地に発育しない。
芽胞は、抵抗性が強く、乾燥状態においても感染性は長期間維持される。消毒には、100℃以上の加熱、ヨード系や塩素系消毒薬が有効である。
本菌の感染は、糞便中に排泄される芽胞を経口的に接種することで成立すると考えられる。マウス、ラット、ハムスター、スナネズミ、モルモット、ウサギ、イヌ、ネコ、ウマ、ウシ、サル類など多くの実験動物、家畜において感染が報告されているが、その多くは不顕性感染で推移する。ただ免疫不全動物あるいは通常動物でもストレスや免疫抑制剤投与実験では発症する恐れがあるので、本菌感染有無を確認しておくことは不可欠である。またハムスターやスナネズミは高感受性であり、下痢や肝炎を引き起こす。
自然感染例における共通の所見は、腸炎と肝炎であり、心筋炎をともなう場合もある。
人工培地による本菌の分離は困難であるため、通常は抗体検査を行う。またPCR法により病変部、感染初期の糞便から本菌の存在を確認することが可能であるが、抗体上昇後の感染後期の材料からは検出できない。
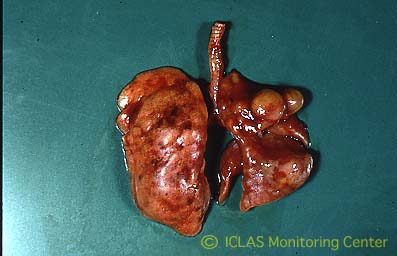
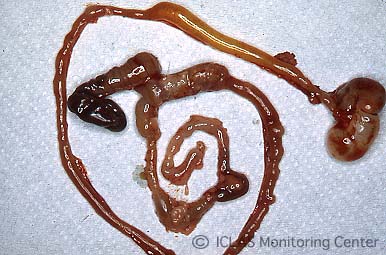
C. piliforme 実験感染ラットの剖検所見: 心筋壊死斑、肝細胞壊死斑 (肝白斑) 散在
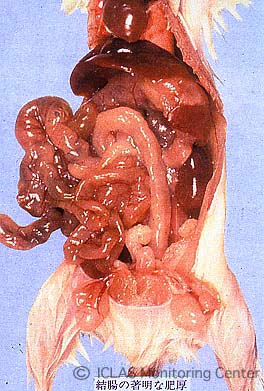
左: C. piliforme 実験感染ラットの腸管病変: 盲腸を中心に回腸下部と結腸上部において粘膜出血、腸管浮腫
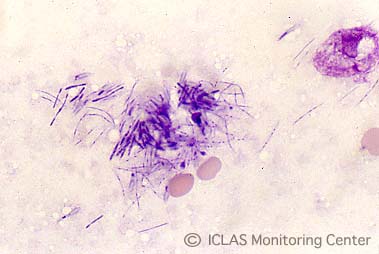
右: C. piliforme 実験感染ラットの肝臓割面スタンプ標本 (May-Giemsa染色)
Corynebacterium kutscheri (ネズミコリネ菌)
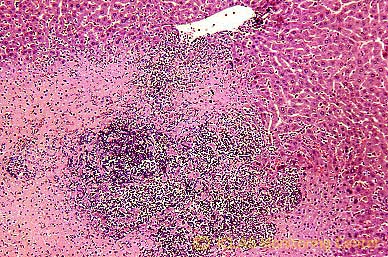
ネズミコリネ菌は、通性嫌気性グラム陽性桿菌で、運動性、芽胞はなく、グラム染色標本では、棍棒状あるいは2個の菌体が対になり八の字形の配列が確認できる。血液寒天培地上のコロニーは、径1~2mmの灰白色、正円で、光沢のない乾いた形態を示す。
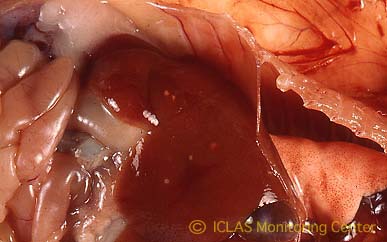
本菌の自然宿主はマウス、ラットであり、多くは不顕性感染にて推移する。しかしステロイドホルモン剤の投与や放射線照射実験により顕性化することがある。病変としては自然感染例で肺、肝、腎などにおける膿瘍形成などが認められる。
伝播は感染動物の糞便等との接触感染により起こる。
診断法は、菌分離 (病変部あるいは気管、口腔のフキトリ材料を血液寒天培地などに塗抹後、37℃、48時間培養) や抗体検査 (ホルマリン不活化抗原を用いた凝集反応) があるが、確定診断のためには菌分離が最適である。
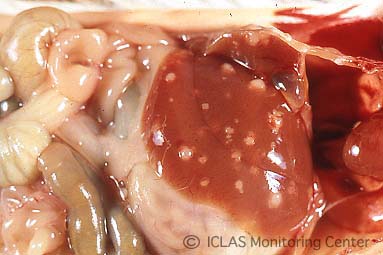
左: C. kutscheri 感染マウスの剖検所見: 肝臓における多発性小膿瘍
右: C. kutscheri 感染マウスの肺病変: 多発性小膿瘍
C. kutscheri 感染ラットの肝組織 (H&E染色像) : 化膿性肝炎
EDIM (Rota) virus (MRV: マウスロタウイルス)
MRVは、伝染性マウス幼子下痢症 (Epizootic diarrhea of infant mice: EDIM) の原因ウイルスで、レオウイルス科に属するRNAウイルスである。
各種動物には固有のrotavirusが存在すると考えられており、病態も共通点が多い。MRVはマウス以外には感染しない。経口的に感染し、生後17日までのマウスは特に感受性が高く、感染後2~10日に高濃度のウイルスを便中に排泄する。感染2日後頃より、水溶性下痢を呈し1週間程度続く。死亡することは稀で、ほとんどは回復する。17日齢以上のマウスが感染した場合、感染後2~4日に少量のウイルスを便中に排泄するが発症しない。
診断法は抗体検査である。
Helicobacter hepaticus 、Helicobater bilis (ヘリコバクター)
ヒトの胃潰瘍の原因としてHelicobacter pylori が発見されて以来、実験動物やその他の動物においても数多くのヘリコバクターが分離されてきた。本属菌はグラム陰性の螺旋状桿菌で、モニタリング検査の対象は、マウスに肝炎や大腸炎を引き起こすH. hepaticus とH. bilis が取り上げられている。
自然宿主は主にマウスである。本属菌の感受性にマウス系統差があることが知られており、感受性系統はA、BALB/c、C3H、CBAなどで、抵抗性系統はC57BL/6である。感受性系統では肝病変を発現することもあるが、抵抗性系統では不顕性感染となる。感受性の性差も認められており、雌より雄で病変発現率が高く、病変の程度も強い傾向にある。
MHVと同様に移植腫瘍株にH. hepaticus が汚染していた事例があることから、本菌汚染の可能性がある場合は、事前に検査を実施した方がよい。
本属菌は培養が比較的困難なこともあり、診断法は盲腸、糞便あるいは病変の認められた肝臓からのPCR法検査が一般的である。
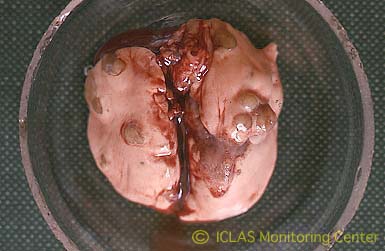
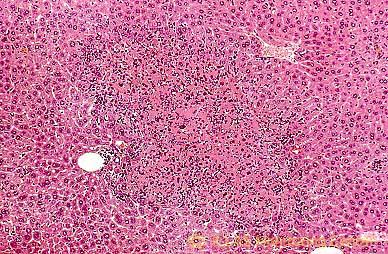
H. hepaticus 実験感染SCIDマウスの肝病変: 肝壊死斑 (肝白斑) 散在
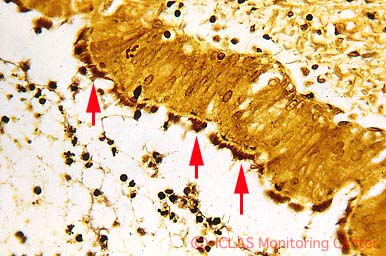
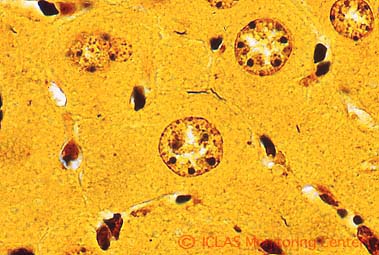
左: H. hepaticus 実験感染SCIDマウスの肝組織 (H&E染色像) : 巣状壊死性肝炎
右: H. hepaticus 実験感染SCIDマウスの肝組織 (Warthin-Starry染色像) : 肝毛細胆管腔内に好銀性の螺旋状桿菌
Lactate dehydrogenase elevating virus (LDHV: 乳酸脱水素酵素上昇ウイルス)
LDHVは、アルテリウイルス科に属するRNAウイルスである。本ウイルスは、当初、腫瘍細胞を接種したマウスで乳酸脱水素酵素 (LDH) の値が急上昇することから、その原因因子として見出された。宿主域はマウスだけで、ラット、ハムスター、モルモット、ウサギおよびこれらに由来する細胞にも感染しない。
感染マウスは、生涯にわたり血液中にウイルスを保有するが、通常、発症することはない。ウイルスはマクロファージで増殖するため、脾臓、リンパ節、肝臓、胸腺にも高濃度のウイルスが存在する。血漿LDH値は生涯にわたり有意に高い値を示す。
感染の診断は、マウス血漿中のLDH値の上昇を測定し、間接的に検査を行うことも可能であるが、脾臓をサンプルとしたPCR法でも検査が可能である。マウス由来の生物材料にLDHVが汚染していた事例があることから、本ウイルス汚染の可能性がある場合は、事前に検査を実施した方がよい。
Mouse adenovirus (MAV: マウスアデノウイルス)
MAVは、アデノウイルス科に属するDNAウイルスである。
自然宿主はマウス、ラットである。MAV-1 (FL) およびMAV-2 (K87) の両ウイルス株ともに、主として経口的に感染するが、自然感染ではマウスやラットに臨床的な症状を示すことはない。
診断法は抗体検査による。
Mouse cytomegalovirus (MCMV: マウスサイトメガロウイルス)
MCMVは、ヘルペスウイルス科に属するDNAウイルスである。
感受性宿主はマウスであるが、実験動物のマウスでの感染例は稀である。自然感染の場合、通常発症することはないが、ウイルスは長期にわたって唾液中に排出される。
診断法は抗体検査による。
Mouse encephalomyelitis virus (MEV: マウス脳脊髄炎ウイルス)
MEVは、ピコルナウイルス科に属するRNAウイルスである。GDVII株やTO株など複数の株が知られている。
感受性宿主はマウスである。伝播力は強いが、いずれの株も病原性は弱く、発病例は極めてまれとされている。
診断法は抗体検査による。
Murine norovirus (MNV: マウスノロウイルス)
MNVは、カリシウイルス科に属するRNAウイルスである。
インターフェロン系が働かない免疫不全マウス (RAG/STAT1欠損マウスなど) で致死的なMNV感染例が報告されたことはあるが、それら以外のマウスでは、たとえ免疫不全マウスでも発症することはないと考えられている。
診断法は抗体検査もしくは盲腸内容物、糞便からのPCR法検査による。
Polyomavirus (PLMV: ポリオーマウイルス)
PLMVは、ポリオーマウイルス科に属するDNAウイルスで、同科にK virus (多くのマウスコロニーで無症状感染) が存在する。
感受性宿主はマウスである。感染は母子間で見られ、尿を介して伝播するが、伝播力は弱く、自然感染では多くが無症状である。実験感染させたヌードマウスで肺、腎臓、脳など複数組織に多巣性に炎症・壊死・腫瘍を形成する。
診断法は抗体検査による。
Pneumonia virus of mice (PVM: マウス肺炎ウイルス)
PVMは、パラミクソウイルス科に属するRNAウイルスである。
マウスに自然感染するほか、ラットやハムスターにも自然感染が見られる。感染は濃厚な接触やエアロゾルを介して、呼吸器系より感染すると考えられる。免疫機能の正常なマウスでは自然感染による発症例は確認されていない。実験感染では、間質性肺炎が見られる。ウイルス抗原は、実験感染後2~7日に気管支上皮や肺胞壁、肺胞マクロファージに検出される。ヌードマウスでは、自然感染例でも慢性経過をたどり、死に至る例も見られる。
診断法は抗体検査による。
Rat Polyomavirus 2 (RatPyV2: ラットポリオーマウイルス2)
RatPyV2は、ポリオーマウイルス科に属するDNAウイルスで、2016年にX連鎖重症複合免疫不全症 (X-SCID) ラットにおける自然感染により発見された。
感染は、主に同居による呼吸器経路で成立するが、食糞や交配によっても成立する場合がある。免疫機能が正常なラットにおける自然感染では無症状であるが、免疫不全ラットでは繁殖率の低下や、ニューモシスティス・カリニとの複合感染により呼吸困難を呈し、死亡する。
診断法は唾液腺(耳下腺および下顎腺)、ハーダー腺からのPCR法検査による。
Reovirus Type 3 (RV3: レオ-3ウイルス)
RV3は、レオウイルス科に属するRNAウイルスである。
感受性宿主はマウスで、糞便-経口で伝播する。臨床症状は感染動物の週齢に依存し、幼若マウスで下痢、油毛症、削痩し、死亡するケースもある。成熟マウスでは不顕性感染となる。
診断法は抗体検査による。
Rodent parvovirus (パルボウイルス)
パルボウイルス科のDNAウイルスで、マウス微小ウイルス (Mouse Minute virus: MMVもしくはMinute virus of mice: MVM) 、Kilham ラットウイルス (Kilhams rat virus: KRV) 、H-1ウイルス (Toolan's H-1 virus) が知られている。また、1990年代から上記の各ウイルスと抗原性が一部異なる新型のパルボウイルスが相次いで報告され、マウスパルボウイルス (MPV-1、2、3) 、ラットパルボウイルス (RPV-1、2) 、ハムスターパルボウイルス (HPV) と呼ばれている。これらのウイルスは培養細胞や他のウイルスの培養液中にコンタミナントとして分離されたものであり、特定の病気の原因ウイルスとして発見されたものではなく、一般的には、不顕性感染である。
腫瘍細胞への親和性が高いことから、移植腫瘍細胞を汚染しやすく、感染した腫瘍細胞の形質を変化させる。したがって、これらの実験においては、実験への影響が考えられる。
ウイルスは糞便、尿、体液等に排泄され、主として経口および経鼻感染により伝播すると考えられる。MPVやRPVもパルボウイルスに共通する基本的な特性をもつが、病原性は確認されていない。
微生物モニタリング検査として、一般的に抗体検査が行われる。腫瘍細胞をはじめ様々な生物試料の汚染を検査するには、動物に接種し抗体産生を検査するMAP (mouse antibody production) やRAP (rat antibody production) テスト、あるいはPCR法が適用される。
Sialodacryoadenitis virus (SDAV: ラット唾液腺涙腺炎ウイルス)
SDAVは、MHVと同じコロナウイルス科に属するRNAウイルスである。ラットに感染性を有するコロナウイルスには、SDAV以外に、これと抗原的には区別できないラットコロナウイルス (RCV) が知られている。
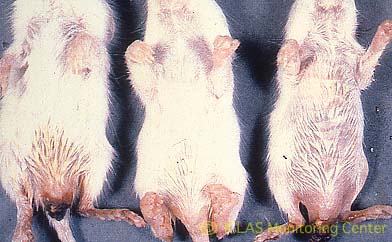
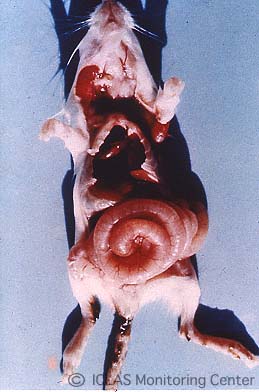
自然宿主はラットのみである。SDAVの伝播力は強く、感染経路はエアロゾルあるいは接触による経鼻感染である。鼻粘膜あるいは咽喉頭粘膜で増殖し、感染後4~5日で唾液腺の腫脹により頚部が太くなり、最盛期には視診でも判別できる。しかし、症状は一過性で、大半は3~5日で回復し死亡することはない。感染動物の中には、「紅涙」や「鼻出血」と呼ばれる眼瞼部や鼻端部の血様赤色物の付着をみることがある。
診断法は抗体検査が一般的であり、SDAVはMHVと抗原性が交差するので、スクリーニング法としてMHV用ELISAキットを用いることができる。
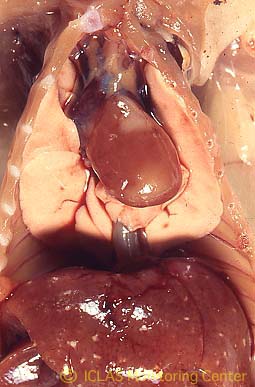
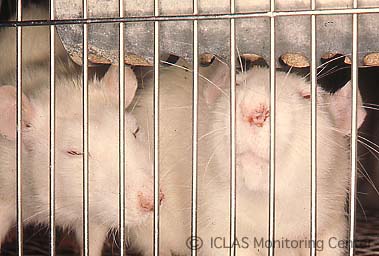
左: SDAV自然感染ラットの外観所見: 腫れぼったい印象 (眼周囲腫脹、下顎部から頚部の腫脹)
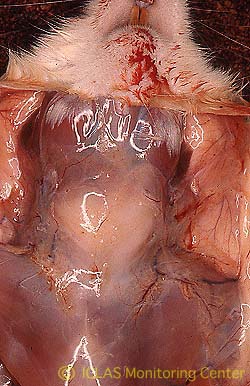
右: SDAV自然感染ラットの剖検所見: 頚部皮下のゼラチン様浮腫、下顎腺および下顎リンパ節腫大
SDAV自然感染ラットのHarderian腺組織 (H&E染色像) : 壊死性炎
Streptococcus pneumoniae (肺炎球菌)
肺炎球菌は、グラム陽性、通性嫌気性、非運動性、無芽胞性円形球菌で、莢膜を有する。多くは2連鎖の配列をするが、まれに短鎖の場合もある。37℃、24時間培養で血液寒天培地上に微小、平滑、光沢のある扁平で、狭いα溶血帯を有するコロニーを形成する。
本菌はラット、モルモットが高い感受性を示し、発病動物では臨床所見として、鼻孔周囲の汚れ (乾燥) 、目やに、食欲減退、立毛、削痩や流産などがみられ、やがて死亡する。病変としては大葉性繊維素性肺炎、心外膜炎、胸膜炎が多くみられ、心外膜と心嚢、肺胸膜と胸壁がしばしば癒着する。サル類も感受性は高いが、病変は呼吸器に限局し、大葉性肺炎となる。マウスにおける自然感染例はほとんどみられない。また本菌はヒトにおいても重要な病原菌であり、大葉性肺炎、菌血症や化膿性髄膜炎などを起こすこともある。
伝播は、感染動物との直接接触や実験者、飼育者の手などを介し間接的に起こり、経鼻感染する。伝播力は比較的弱く、同居動物が必ずしも感染発病するとは限らない。
本菌の診断法は、鼻腔および気管粘膜のフキトリ材料からの菌分離が最適である。
消化管内原虫
(1) Giardia muris (ジアルジア; カテゴリーC)
7~13×5~10μmで、丸みをおびた洋梨形で、4本の鞭毛を有する鞭毛虫類である。皿が回転するような特徴的な動きをする。実験動物ではマウス、ラット、ハムスター、スナネズミが自然宿主である。主として十二指腸に寄生する。多くの場合無症状で経過する。発病個体には、腹部膨満、下痢などが認められる。免疫不全動物では、通常動物に比べ発病する可能性が高い。
(2) Spironucleus muris (スピロヌクレウス; カテゴリーC)
7~9×2~3μmで、他の原虫に比べ小型で細長く、動きは早く直線的である。前部に6本、後部に2本の鞭毛を有する鞭毛虫類である。実験動物ではマウス、ラット、ハムスター、スナネズミが自然宿主である。主として小腸上部に寄生する。一般的に幼若マウスでは発病しやすいとの報告があるが、多くの場合無症状で経過する。発病個体には、下痢、体重減少が認められ死亡する場合もある。免疫不全動物では、通常動物に比べ発病する可能性が高い。


- A. 人獣共通感染症
- B. 伝染力が強く動物を致死させる恐れがある微生物
- C. 致死させることはないが発病あるいは不顕性感染を起こす微生物
- D. 日和見病原体
- E. 通常は病原性はないが、飼育環境の指標になる微生物